Elementlerin modern sisteme en yakın sınıflandırılması 1869 yılında Julius Lothar Meyer (Julis Lother Mayer)’in ve özellikle de Dimitri Mendeleyev’in çalışmalarına dayanmaktadır. Meyer, bilinen elementleri atom kütlelerine göre sıraladı. Rus kimyager Mendeleyev ise elementlerin atom kütlelerine göre sıralandığında düzenli (yani periyodik) olarak yinelenen özellikler gösterdiğini gözlemledi. 63 elementi artan atom kütlelerine göre ve özellikleri birbirine benzeyenler alt alta gelecek şekilde sıraladı. Böylece ilk periyodik sistemi oluşturdu.
Mendeleyev yaptığı çalışmalarda her 8 veya 18 elementte bir benzer özelliklerin tekrarlandığını görmüştür. Tekrarlarda sisteme uymayan atlamaların olduğunu, bu atlamaların daha sonra bulunacak elementlerle doldurulabileceğini öngörmüş ve söz konusu elementler için boşluklar bırakmıştır.
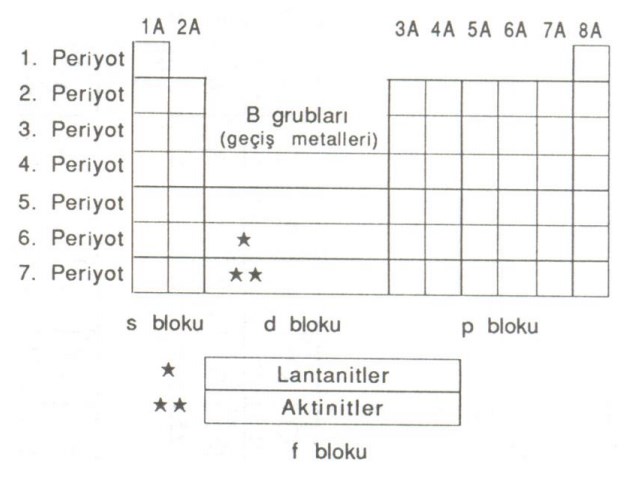
Elementler benzer özelliklerine göre sınıflandırılır. Elementlerin benzer özelliklerine göre sınıflandırılmasıyla oluşturulan tabloya periyodik cetvel denir. Periyodik cetvelde, elementler artan atom numaralarına göre dizilmiş ve benzer özellikteki elementler alt alta gelmiştir. Periyodik cetvele periyodik tablo ya da periyodik çizelge de denir.
Grup ve Periyot
Periyodik cetveli oluşturan yatay sıralara periyot adı verilir. Yatay sıralarda atom numaraları arttıkça elementlerin fiziksel ve kimyasal özellikleri değişir. Periyodik cetveldeki düşey sütunlara grup denir. Aynı gruptaki elementler benzer kimyasal özellikler gösterir.Periyodik cetvelde 8 tane A ve 8 tane B olmak üzere 16 tane grup vardır. Periyodik cetvel 18 sütundan oluşur. B gruplarından üç tanesi birden 8B olarak isimlendirilir. Periyodik cetvelde elementler, elektron dağılımlarına bağlı olarak s, p, d, f şeklinde dört bloka ayrılır. Elektron dağılımındaki son orbital, elementin bulunduğu bloku belirler. Elektron dağılımı;
- s ile bitenler s blok,
- p ile bitenler p blok,
- d ile bitenler d blok,
- f ile bitenler f blokta yer alır.
s ve p blok elementleri A gruplarını, d blok elementleri B gruplarını oluşturur. d blok elementlerine geçiş elementleri, f blok elementlerine iç geçiş elementleri denir.
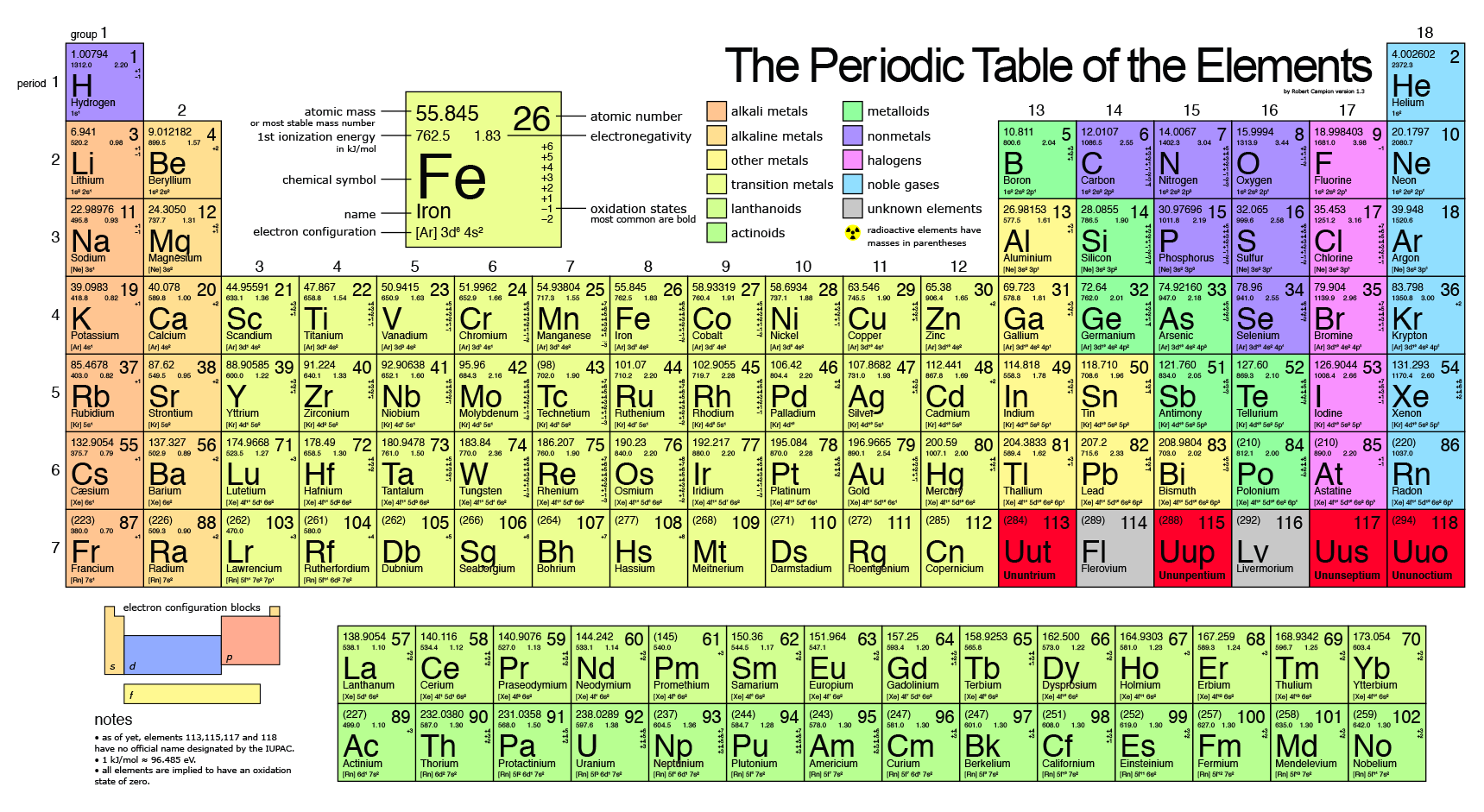
Periyodik Tablo
Elementlerin periyodik cetveldeki yerlerinin bulunması: Atom numarası bilinen bir elementin elektron dağılımından yararlanarak periyodik cetveldeki yeri bulunabilir. Bunun için şu sıra takip edilir:
1- En yüksek temel enerji düzeyini gösteren baş kuantum sayısı, o elementin bulunduğu periyodu belirler.
2- En yüksek enerji düzeyindeki toplam elektron sayısı, o elementin grubunu belirler.

C elementi 2.periyot IVA grubunda bulunur. Örnek: 17Cl ve 33As elementlerinin periyodik cetveldeki yerini bulunuz. Çözüm:
- 17Cl: 1s2 2s2 2p6 3s2 3p5 3.periyot VIIA grubu
- 33As: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 4.periyot VA grubu
Periyodik Özellikler
Periyodik cetvelde elementlere ait bazı özellikler elementlerin atom numaralarındaki değişmeye paralel olarak devirli biçimde tekrarlanır.
Bir periyotta soldan sağa doğru gidildikçe;
- Proton, nötron sayıları ve kütle numarası artar.
- Atom numarası artar.
- Değerlik elektron sayısı artar.
- Elektron alma isteği (ametalik karakter) artar.
- Yörünge sayısı değişmez.
- Atom hacmi ve çapı azalır.
Bir grupta yukarıdan aşağıya inildikçe;
- Proton, nötron sayıları ve kütle numarası artar.
- Atom numarası artar.
- Değerlik elektron sayısı değişmez (Bu nedenle aynı gruptaki elementlerin kimyasal özellikleri benzerdir.).
- Elektron verme isteği (metalik karakter) artar.
- Yörünge sayısı artar.
- Atom hacmi ve çapı artar.
Atom Yarıçapı
Bir periyotta soldan sağa doğru, çekirdek yükü ve çekirdeğin elektronları çekme gücü artar. Buna bağlı olarak atom çapı küçülür.
Aynı grupta yukarıdan aşağıya doğru, atom numarası arttıkça enerji düzeyi (yörünge) sayısı da artar. Çekirdeğin elektronları çekme gücü azalır. Bundan dolayı atom çapı artar. Yüksüz bir atom negatif yüklü iyon hâline geçerken elektron alır. Elektron sayısı proton sayısından fazla olduğundan çekirdeğin çekim gücü azalır ve hacmi büyür. Yüksüz bir atom pozitif yüklü iyon hâline geçerken elektron verir. Proton sayısı elektron sayısından fazla olduğundan çekirdeğin çekim gücü artar ve çapı küçülür.
Örnek: 11Na+ , 12Mg2+ ve Fiyonlarının çaplarını karşılaştırınız.
Çözüm: İyon yükü = proton sayısı – elektron sayısı
- 11Na+ için elektron sayısı = 11 – 1 = 10 11Na+ : 11 proton 10 elektron
- 12Mg2+ için elektron sayısı = 12 – 2 = 10 12Mg2+ : 12 proton 10 elektron
- 9F – için elektron sayısı = 9 + 1 = 10 9F – : 9 proton 10 elektron
Proton sayısı arttıkça çekirdeğin elektronları çekim gücü de artar ve iyon çapı küçülür. Buna göre iyon çaplarının sıralaması 12Mg2+ < 11Na+ < F- şeklinde olur.
Elektronegatiflik
Elektronegatiflik, bir molekül içindeki bir atomun elektronları çekme yeteneğinin bir ölçüsüdür. Genel olarak elektronegatiflik, periyotlarda soldan sağa doğru gidildikçe değerlik elektron sayısının artmasıyla artar. Gruplarda ise yukarıdan aşağı doğru inildikçe atom büyüklüğünün artmasıyla azalır. En elektronegatif atom flüordur.
Örnek: 7N ve 😯 atomlarından hangisi daha elektronegatiftir?
Çözüm: Atomların periyodik cetveldeki yerleri bulunarak elektronegatiflikleri hakkında yorum yapılabilir.
- 7N : 1s2 2s2 2p3 2.periyot 5A grubu
- 😯 : 1s2 2s2 2p4 2.periyot 6A grubu
Aynı periyotta soldan sağa doğru gidildikçe elektronegatiflik artar. Bu yüzden O atomu daha elektronegatiftir.







Ezra
25 Kasım 2020 at 19:10
Aşşırı iyi olmuş .Teşekkürler ♥