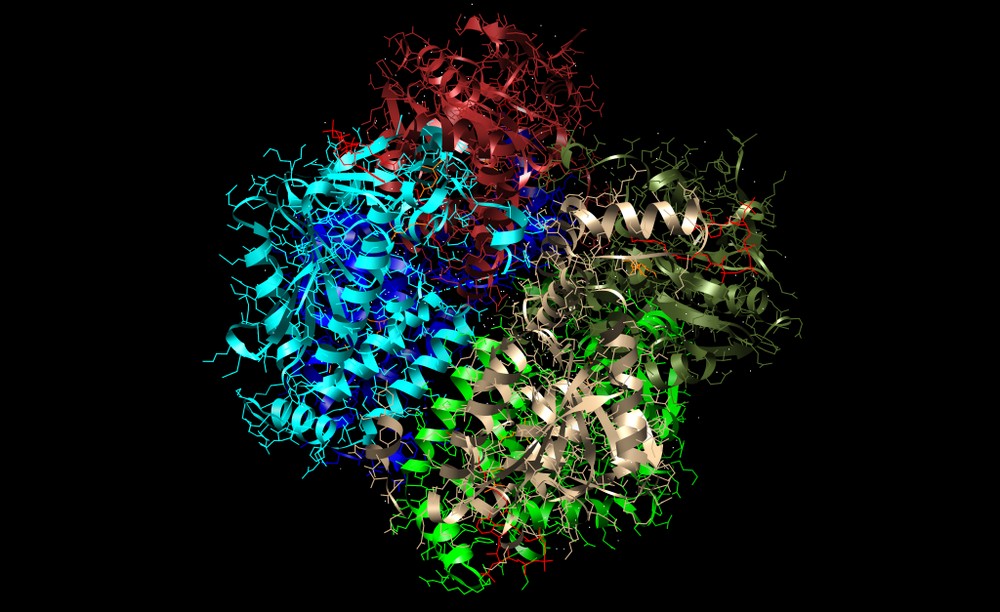
Enzimler, kataliz yapan (yani kimyasal tepkimelerin hızını artıran) biyomoleküllerdir. Neredeyse tüm enzimler protein yapılıdır. Enzim tepkimelerinde, bu sürece giren moleküllere substrat denir ve enzim bunları farklı moleküllere, ürünlere dönüştürür. Bir canlı hücredeki tepkimelerin neredeyse tamamı yeterince hızlı olabilmek için enzimlere gerek duyar. Enzimler substratları için son derece seçici oldukları için, ve pek çok olası tepkimeden sadece birkaçını hızlandırdıklarından dolayı, bir hücredeki enzimlerin kümesi o hücrede hangi metabolik yolakların bulunduğunu belirler.
Her katalizör gibi enzimler de bir tepkimenin aktivasyon enerjisini (Ea veya ΔG‡) azaltarak çalışır ve böylece tepkime hızını çarpıcı şekilde artırır. Çoğu enzim tepkimesi, ona karşılık gelen ve katalizlenmeyen tepkimeden milyonlarca kere daha hızlıdır. Diğer katalizörler gibi enzimler de katalizledikleri tepkime sonucunda tükenmez, ve bu tepkimelerin dengesini değiştirmez. Ancak, diğer çoğu katalizörden farklı olarak enzimler çok daha özgüldür (spesifiktir). Enzimlerin 4000’den fazla biyokimyasal tepkimeyi katalizlediği bilinmektedir.
Enzimlerin büyük çoğunluğu protein olmakla beraber, ribozim adlı bazı RNA molekülleri de tepkimeleri katalizler, bunun en iyi bilinen örneği ribozomu oluşturan bazı RNA’lardır.
Enzimlerin etkinliği başka moleküller tarafından etkilenebilir. İnhibitörler enzim aktivitesini azaltan moleküllerdir, aktivatörler ise enzim aktivitesi artıran moleküllerdir. Etkinlik ayrıca sıcaklık, kimyasal ortam (örneğin pH) ve substrat konsantrasyonu tarafından etkilenir. Bazı enzimler endüstriyel amaçla kullanılırlar, örneğin antibiyotik sentezinde. Ayrıca bazı ev ürünlerinde biyokimyasal tepkimeleri hızlandırmak için enzim kullanılır (örneğin, çamaşır tozunda bulunan enzimler lekelerdeki protein ve yağları parçalar).
Enzimler birkaç farklı yolla çalışırlar, bunların hepsi aktivasyon enerjisini (ΔG‡) azaltır:
1- Geçiş durumunu stabilize olduğu bir ortam yaratarak (örneğin, substratın şeklini zorlayarak – substrat/ürün molekülünün geçiş hâl biçimine bağlanarak enzim bağlı substrat(ları) çarpıtır ve geçişin tamamlanması için gerekli enerji miktarını azaltır)
2- Geçiş halinin enerjisini azaltarak, örneğin geçiş halindekinin tersi bir yük dağılımına sahip bir ortam yaratarak.
3- Alternatif bir yol sağlayarak. Örneğin, substratla geçici olarak tepkiyerek bir ES kompleksi oluşturarak.
4- Substratları tepkimeleri için onları doğru yönde bir araya getirerek tepkime entropi değişikliğini azaltarak. ΔH‡ değerine tek başına bakmak bu etkiyi göz ardı eder.
İlginç bir şekilde, bu entropik etki, temel halin destabilizasyonu ile ilişkilidir, ve katalize olan katkısı göreli olarak düşüktür.